-
TIM3 乳腺癌細胞在微轉移爆發期介導免疫逃逸
發布時間: 2025-07-29 點擊次數: 1128次2024年7月10日,《Cancer Cell》在線發表Mar醫院研究所Toni Celià-Terrassa團隊的突破性成果。研究揭示,TIM3?乳腺癌細胞在微轉移“爆發窗口"中扮演免疫逃逸主控角色:于免疫健全宿主內,TIM3在定植初期即被選擇性上調,驅動細胞獲得增強的干性、生存力與免疫隱身能力,從而成為轉移級聯的核心引擎。

背景:
轉移性乳腺癌仍無gen治手段,每年導致近70萬人死亡。現行輔助/新輔助治療旨在清除微轉移灶,卻受限于其免疫機制不明:多數播散細胞死于遠端脅迫,僅少數具備干性與EMT特征的MICs存活并逃逸免疫。肝臟耐受性微環境更使轉移灶對免疫治療遲鈍。免疫檢查點TIM3本以T細胞耗竭而聞名,新近發現亦高表達于乳腺癌細胞,激活AKT/β-catenin信號,卻未知其在微轉移中的角色。本研究證實,TIM3在乳腺癌細胞富集預示預后不良,并直接賦予MICs存活、干性與免疫逃逸能力,為阻斷微轉移提供潛在新靶。

結論1: 建模實驗轉移免疫編輯
以未免疫編輯的EpRas乳腺癌細胞構建全身轉移模型,比較免疫缺陷與免疫健全小鼠。生物發光顯示健全鼠轉移顯著受抑;RNA-seq及聚類證實免疫選擇主導轉錄差異,富集免疫抑制、EMT和干性通路,TIM3在腫瘤細胞普遍上調,肝轉移尤甚。4T07模型進一步驗證免疫壓力下TIM3表達升高,提示其介導逃逸與干性的治療靶點。
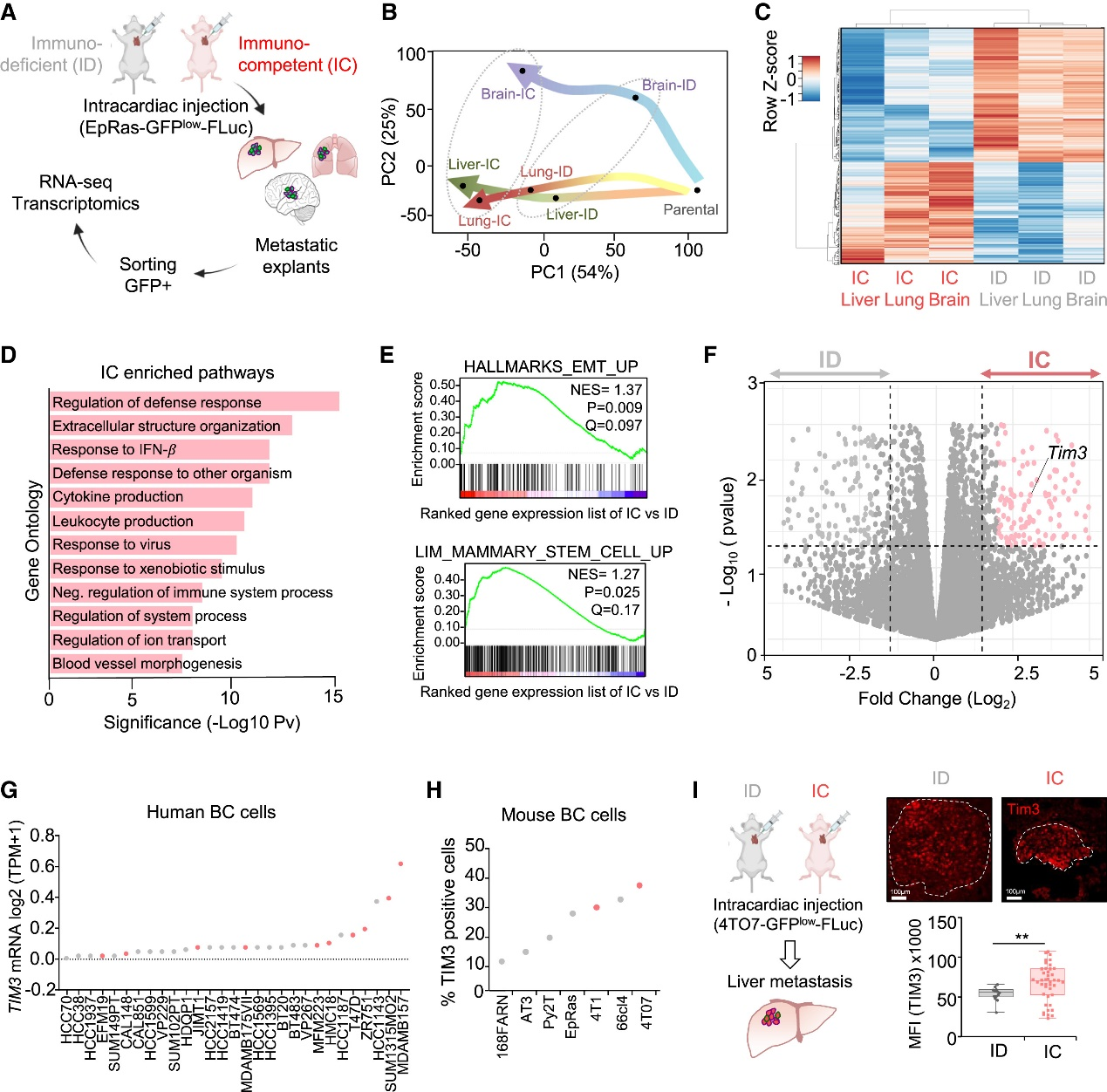
Fig1. 轉移免疫壓力正向選擇 TIM3+ 轉移細胞
結論2: TIM3 在免疫壓力下促進乳腺癌轉移能力
以未免疫編輯的EpRas細胞建立全身轉移模型,比較免疫缺陷與免疫健全小鼠。健全鼠轉移受抑,RNA-seq顯示免疫選擇塑造轉錄譜,富集免疫抑制、EMT與干性;TIM3在腫瘤細胞普遍上調,肝轉移更甚。4T07模型證實免疫壓力下TIM3升高,提示其介導逃逸與干性的治療靶點。

Fig2. TIM3 驅動乳腺癌轉移
結論3:TIM3 與 EMT 樣細胞相關并激活 β-catenin 信號轉導
用未免疫編輯的EpRas-FLuc-GFP低表達細胞,經心腔注射建立乳腺癌全身轉移模型,對比NSG免疫缺陷與Balb/c免疫健全小鼠。BLI顯示健全鼠轉移負荷顯著降低;20天后分離肺、肝、腦灶,流式純化腫瘤細胞,RNA-seq無免疫細胞污染。PCA與聚類證實免疫選擇主導轉錄差異;GO/GSEA示健全鼠來源細胞富集免疫抑制、干性及EMT通路。TIM3在腫瘤細胞普遍上調,肝轉移尤甚。高表達TIM3的4T07模型進一步驗證免疫壓力下TIM3升高,提示其介導逃逸與干性的可靶機制。
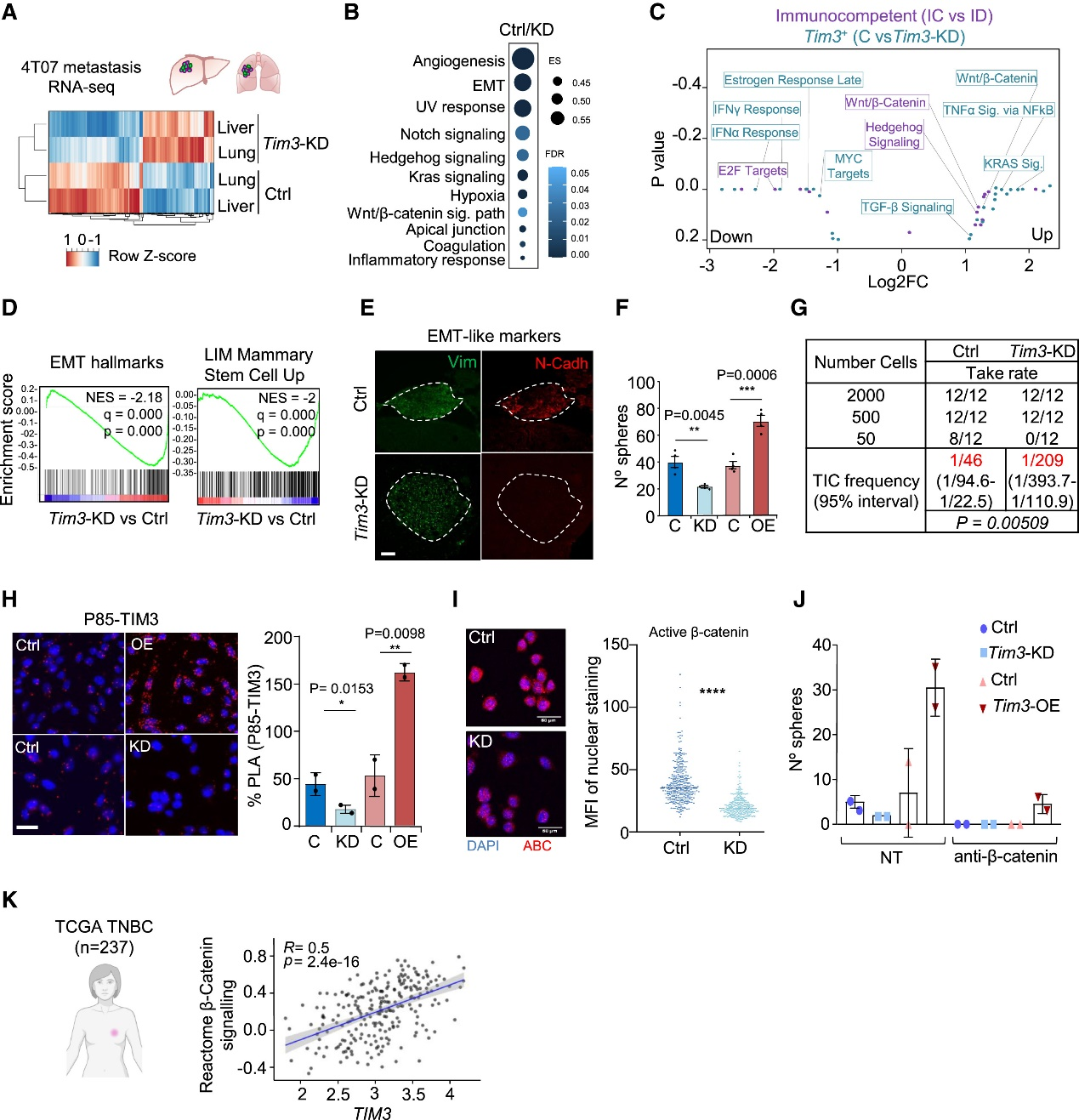
Fig3. TIM3 MIC 顯示干性/EMT 樣特征和 β-catenin 激活
結論4: TIM3 腫瘤細胞在微轉移中的時空分析
為捕捉TIM3?細胞早期定植,4T07-FLuc-GFP經心腔注射后0、6 h及3 d BLI示6 h已分布多器官,肝切片證實DTC存在;3 d后免疫健全鼠信號驟降,表明多數DTC早期即被清除。繼而構建Tim3-mCherry-Nluc雙報告系統,以流式及BLI實時追蹤Tim3啟動子活性,驗證mCherry與TIM3蛋白高度一致。

Fig4. TIM3 轉移中的時空動力學
結論5:TIM3 MIC 重塑微轉移的免疫抑制免景觀
單細胞測序顯示,TIM3?微轉移灶內免疫抑制細胞(IL-17?γδ T、Arg1?單核/中性粒)顯著增多,效應CD8? T、DC及殺傷性中性粒減少;細胞互作增強抑制信號。光譜流式證實TIM3敲低可逆轉該抑制微環境,表明TIM3?腫瘤細胞通過重塑免疫格局實現早期免疫逃逸。

Fig5. TIM3 MIC 在微轉移過程中誘導免疫抑制環境
結論6:γδT細胞在肝微轉移過程中發揮重要作用
scRNA-seq分析4T07對照與Tim3敲低小鼠的肝微轉移、巨轉移及鄰近組織CD45?免疫細胞,鑒定27群并發現微轉移期變化zui顯著:TIM3?灶內IL-17?γδ T、Arg1?單核/中性粒等抑制細胞增多,CD69?Gzmb?CD8? T、DC及殺傷性中性粒減少;細胞互作增強抑制信號。光譜流式驗證TIM3?微轉移灶IL-17?γδ T升高、CD8?活化下降。結論:TIM3? MICs在早期通過招募抑制細胞、削弱效應T細胞,營造促瘤免疫微環境。
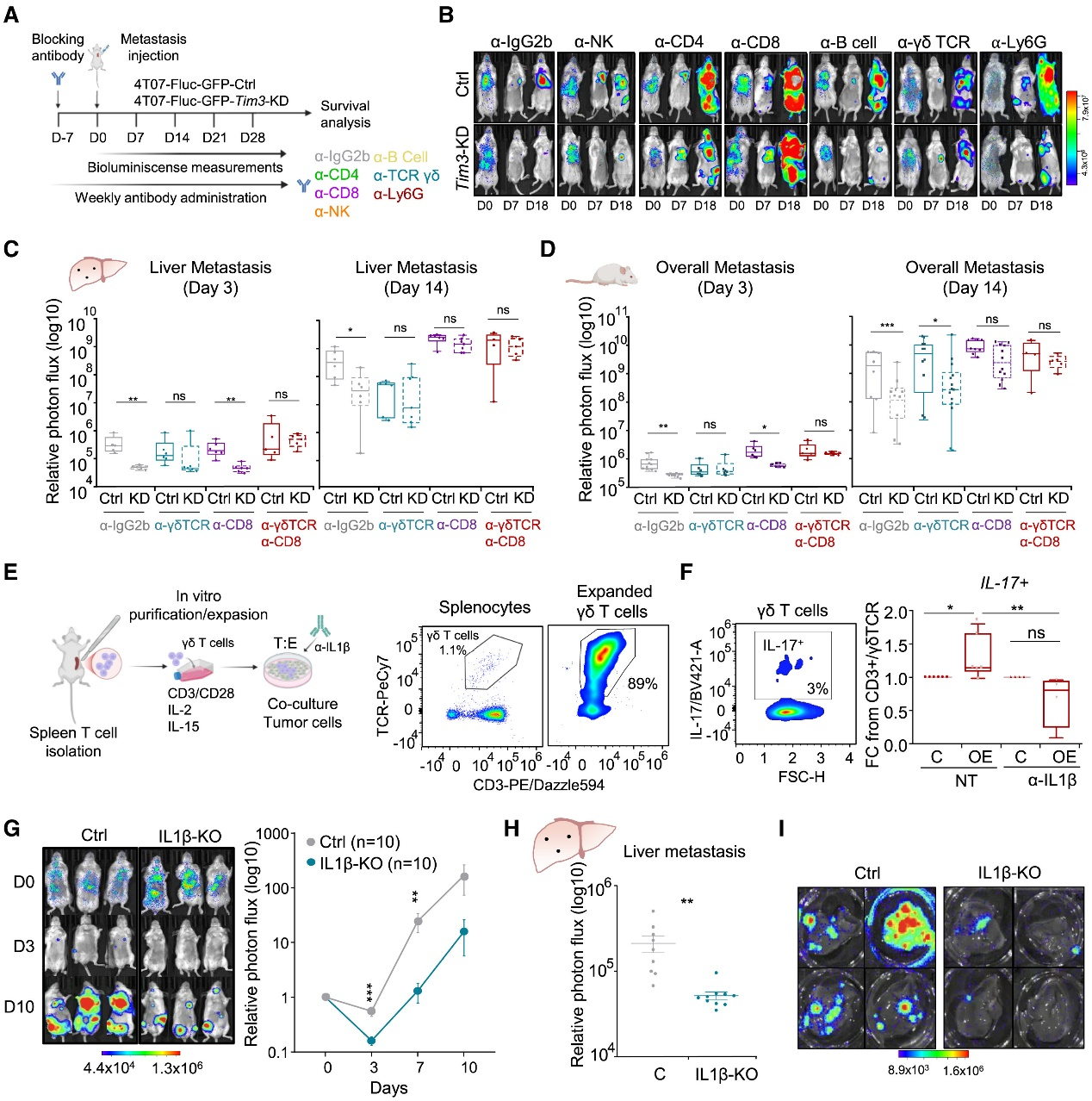
Fig6. TIM3介導的免疫抑制中γδ T細胞、CD8+T細胞和IL-1β的
功能轉移評估
結論7:表達 TIM3 的腫瘤細胞獨立預測乳腺癌患者預后不佳
257例乳腺癌IHC顯示,腫瘤細胞TIM3高表達預示無病及總生存期縮短,且獨立于T細胞TIM3;TNBC及III期風險最高。門脈接種與切除模型中,抗TIM3顯著減少肝、肺早期轉移,不影響原發瘤;療效與TIM3敲低等同。結果支持TIM3作為復發高危標志,并推薦II/III期(新)輔助抗TIM3臨床試驗。

Fig7. TIM3阻斷治療乳腺癌轉移的臨床和臨床前評價
研究局限性
本研究受限于人體細胞無法在完整免疫體系中應用,故采用同基因小鼠模型;熒光標記雖具免疫原性,但未標記細胞仍重現TIM3表型。實驗涵蓋EpRas、4T1、4T07、66cl4及AT3五種BC模型,前二者用于全身轉移,后三者用于自發轉移;4T07與4T1均攜帶Trp53熱點突變,模擬高TIM3表達的人類TNBC。





